nature重磅研究:生酮饮食预防结肠癌,最详细的解读
- - 阅 3,9432天前,医学顶刊Nature杂志上,发表了一项炸弹研究:
β-Hydroxybutyrate suppresses colorectal cancer.。
图片来自www.nature.com
这项由宾夕法尼亚大学Perelman医学院Christoph A. Thaiss和Maayan Levy教授合作完成的研究,得出了明确的结论:
生酮饮食通过产生酮体β-羟基丁酸(BHB),抑制了结直肠癌的发展。
前几天,我们刚写了生酮饮食能够增强化疗效果,有助于杀死胰腺癌细胞。
今天的研究就更厉害了,不需要化疗,仅仅通过饮食就能显著减小肿瘤的数量和大小。
不敢相信?那就看看这项研究是怎么进行的吧,保证让你心服口服。
Nature:生酮饮食能够抑制肿瘤生长
为了确定影响肠道肿瘤生长的饮食干预,研究者设计了具有确定的常量营养素来源,恒定蛋白质含量,和不同脂肪与碳水化合物比率的小鼠饮食,如下图:
我们可以从图中看出,研究人员设置了两种脂肪含量为90%的生酮饮食(KD),一种脂肪来源于猪油(lard),另一种来源于植物油(Crisco,一种植物起酥油,主要是大豆油)。
在喂食这六种不同饮食的小鼠中,研究者通过注射偶氮甲烷(AOM),和三个周期的葡聚糖硫酸钠(DSS),来诱导结直肠癌(CRC)的发生。
结果发现,随着脂肪与碳水化合物比例的增加,肿瘤的数量和大小受到抑制(图a-f),并且生酮饮食提高了CRC小鼠的长期存活率(图g)。
此外,KD 抑制了 CRC 遗传模型中的肿瘤发展(图 d、e、h-j);在不同的动物饲养条件下(vivarium1和2),都能观察到这种效应(图 k-p)。
为了评估生酮饮食,是否可用于治疗现有的结直肠肿瘤,研究人员对小鼠,进行延迟暴露范例,即在第二个葡聚糖硫酸钠(DSS)周期后,开始生酮饮食喂养。
结果表明,生酮饮食有效地抑制了肿瘤生长的进展;而在停止生酮饮食后,导致了肿瘤再生。
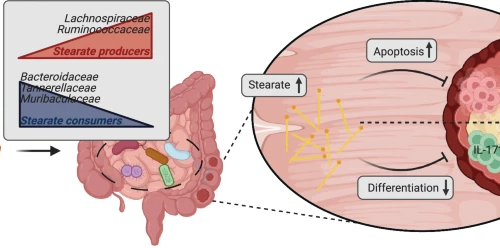
→β-羟基丁酸(BHB)抑制肠道肿瘤生长
这些实验结果都表明,生酮饮食在预防和治疗模型中,都有效地抑制了结直肠肿瘤的生长,研究人员接下来继续研究,生酮饮食对结肠肿瘤发展的影响的机制。
他们排除了热量摄入的差异;随后又排除了生酮饮食减少产生IL-17的T细胞,和抑制NLRP3炎症小体的作用。
因为各组的热量摄入无显著差异;适应性免疫细胞在功能上,并不是饮食因素所必需的。
图片来自:www.medgadget.com
而无论宿主是否表达NLRP3 炎症小体,都能观察到KD的肿瘤抑制作用。
研究人员随后使用了一个类器官系统,证实了生酮饮食,能够直接影响Lgr5+细胞的功能,从而减少肠道上皮的干细胞的增殖。
类器官(Organoids),利用干细胞直接诱导生成三维组织模型,类似于组织器官。可复制出已分化组织的复杂空间形态,并能够表现出细胞与细胞之间、细胞与其周围基质之间的相互作用和空间位置形态。 而其本身又能做到,与体内分化的组织器官具有相似的生理反应,与来源组织具有极高的相似性。
→什么是生酮饮食(KD)
这是一种高脂肪,低碳水的饮食,能够刺激肝脏,产生酮体乙酰乙酸 (AcAc),和β-羟基丁酸(BHB)。
为了确定KD对上皮生长的抑制作用,是否由酮体介导,研究者监测了在AcAc,或BHB存在下,培养的肠类器官。
结果发现,在仅有AcAc存在的条件下,类器官的生长没有变化;但随着BHB的浓度增加,类器官的大小随之减小,且没有影响类器官的活力。(BHB 的有效浓度,与KD喂养在肠道中达到的组织水平相似)
除了诱导肝脏生酮外,KD还可以降低全身葡萄糖水平,和增强胰岛素敏感性,这些效应均有健康益处。
为了确定BHB和葡萄糖限制,对减少肿瘤的影响大小,研究者使用不同的葡萄糖浓度,用 BHB处理类器官。
结果显示,BHB的补充,减少了每种葡萄糖浓度下的类器官生长,表明葡萄糖限制和补充BHB,可能通过不同的机制起作用。
基于这些结果,研究人员推测,生酮饮食通过BHB这一代谢物,减少肠道上皮干细胞增值,和肿瘤生长。
→BHB通过Hopx抑制肿瘤生长
研究者接下来研究了BHB介导的肿瘤抑制的机制,对 BHB处理的类器官,进行了 RNA 测序(RNA-seq),发现BHB诱导了全部基因表达的显著变化。
在 BHB上调的基因中,编码仅同源结构域的蛋白Hopx是一种推定的致瘤性负调节因子。
为了证实Hopx对BHB介导的肿瘤生长抑制机制的作用,研究者将Hopx缺陷小鼠,和野生型小鼠的类器官,同时暴露于BHB。
结果发现,BHB减少了野生型类器官的生长,而Hopx缺陷类器官,对BHB的处理具有抗性。
左:Hopx缺陷类器官 右:野生型类器官
研究者接下来要确定Hopx是否由生酮饮食诱导,发现接受KD的小鼠,显示结肠组织中 Hopx水平升高,并在诱导结肠肿瘤后,Hopx水平进一步升高。
为了确定KD和BHB的肿瘤抑制作用,是否需要Hopx表达,研究者给Hopx缺陷小鼠和野生型小鼠均使用生酮饮食,并诱导CRC。
结果显示,野生型组在KD喂养后,肿瘤生长明显减少;但该饮食对缺乏Hopx的小鼠无效。
WT:野生型 Hopx;KO:Hopx缺陷型;KD:生酮饮食
为了深入了解Hopx介导KD肿瘤生长抑制作用的分子机制,研究者对 AOM/DSS 处理的野生型和Hopx缺陷小鼠的结肠组织,进行了RNA-seq。
差异表达基因的功能注释显示,在缺乏Hopx的小鼠中,增殖途径强烈上调,其中包括几个参与细胞周期调节的基因。
总之,以上结果均表明,KD和BHB诱导的Hopx表达增加,会减少肠道上皮生长,和结肠肿瘤发生。
→BHB诱导Hopx的表达需要Hcar2
研究者通过实验证明了,BHB抑制组蛋白脱乙酰酶HDAC的活性,和DNA甲基化状态的变化,并不会影响BHB诱导Hopx的表达。
为了确定BHB影响Hopx转录的机制,研究者对可能在BHB机制下游起作用的候选基因,进行了CRISPR筛选。
CRISPR是指有效编辑有机体内部分基因的技术。目前根据不同的Cas核酸酶来分类一共有三种不同的系统。其中二型的比较简单,是以Cas9核酸酶以及向导RNA(gRNA)为核心组成。
这些候选基因包括 BHB受体,Hcar2和Ffar3(也分别称为 Gpr109a和Gpr41),以及其他几个受 BHB影响的基因。
小鼠的类器官,分别被向导RNA (gRNA) 靶向,每个候选基因,平均使用四个不同的gRNA,然后将类器官暴露于BHB,并测量它们的生长。
结果发现,BHB显著减少了大多数基因缺陷类器官的生长,但缺乏Hcar2的类器官,并没有表现出类似的效应。
为了验证Hcar2对BHB的影响,研究者将Hcar2缺陷小鼠的类器官,分别暴露于BHB、丁酸盐或伏立诺他。
尽管 BHB显著减少了野生型对照中类器官的大小,但Hcar2缺陷小鼠的类器官,在 BHB 存在下继续生长(图b)。
相比之下,Hcar2缺陷小鼠暴露于丁酸盐和伏立诺他之后,类器官的生长受到抑制;Hcar2 缺乏阻止了BHB诱导的Hopx上调,而丁酸盐不诱导Hopx(图c)。
总的来说,这些结果表明, BHB通过表面受体Hcar2,诱导Hopx表达,并抑制上皮生长。
→BHB对人类肿瘤细胞的影响
刚才洋洋洒洒介绍了一大堆小鼠实验,研究人员接下来还探讨了BHB-Hopx途径,是否同样有效地抑制人类肠道上皮的增殖。
结果发现,BHB 减少了健康者,和CRC患者类器官的生长,表明了BHB-Hopx途径,对人类的肿瘤类器官,具有抑制作用。
a、b为健康者;c、d为CRC患者
与在小鼠中的发现相似,BHB导致人类类器官中Hopx表达升高(图d);在人CRC细胞系 HT-29 中,也观察到 BHB 的抗增殖作用(图e),以及在不同葡萄糖浓度下的S期细胞比例降低(图f-g , S期即DNA合成期,DNA数目在此期加倍)。
研究者还收集了41 名CRC 患者的血清,并测量了他们的BHB水平,以了解血清 BHB 与 CRC 患者大肠中结肠Hopx水平的关系。
值得注意的是,在上皮亚群中,BHB水平与Hopx表达呈正相关(图e),与细胞周期进程呈负相关(图f-h)。
这些数据共同表明,BHB可以提高Hopx水平,并抑制人类肠道上皮细胞的增殖。
关键的瘦龙说
关于生酮饮食与肿瘤关系的研究,我们之前也写过很多了。(公众号回复癌症)
但是,像今天这篇这样,发表在顶刊上,而且既有动物研究,又有人类研究的,是独一份。
对生酮饮食产生的酮体,很多专家的认知还停留在,酮酸中毒,不敢生酮,其实,只有胰岛素水平分泌功能缺失的人,才有这个风险。
而且越来越多的研究发现酮体,有更多的代谢益处,对大脑的益处,很多老人生酮后痴呆缓解,酮体对食欲有帮助,对线粒体有益处。
正常人生酮,如果你有胰岛素分泌功能,会进入营养性生酮状态,没有酮酸中毒风险。
当然,也并不是所有的研究都显示出正向的结果,某些研究可能会告诉你,生酮饮食有不良的影响。
这也带给我们启示,我们可以继续研究,酮体给身体带来的潜在健康作用。
这个研究发现的减缓肠道肿瘤生长的 BHB-Hcar2-Hopx信号轴,为酮体的生物学研究,增加了一个新方向。
值得注意的是,在制定具体的预防和治疗建议之前,都需要进行前瞻性随机对照研究。
让我们拭目以待吧。
======进群、领取食谱,联系瘦龙=====
瘦龙每天都在公众号(瘦龙健康)这里发布文章,大家一定要关注哦。关注公众号后,请回复食谱二字,获取食谱。

长按图片扫码关注哦
如果你想进群,可以扫描下面的码哦。

原文地址:http://www.chinalowcarb.com/keto-and-colorectal-cancer/关注微信公众号:『瘦龙健康』,及时获取最新低碳生酮相关的文章,公众号回复减肥,糖尿病,获取相关科普文章推荐。